
المحتوى
الكاتلاز هو إنزيم موجود في خلايا الحيوانات والنباتات والبكتيريا الهوائية. الإنزيم عبارة عن جزيء كبير ، يتم تصنيعه في الخلايا ويتم إنتاجه ليكون بمثابة محفز في التفاعل. يؤدي كل نوع من أنواع الإنزيمات وظيفة محددة ، وتتمثل وظيفة الكاتالاز في تحويل منتج ثانوي يحتمل أن يكون ضارًا إلى عناصر مفيدة للخلية.

وظيفة
الكاتلاز ، مثل معظم الإنزيمات ، هو بروتين. تم العثور عليها في بيروكسيسومات ، والتي هي عضيات الخلايا الغشائية. للكاتالاز وظيفة بيولوجية مهمة: فهي تحفز تحلل بيروكسيد الهيدروجين ، وهو مادة سامة للكائنات الحية ، في الماء والأكسجين الجزيئي ، وهما غير ضاران ومفيدان.

هيكل
يحتوي هيكل الدمبل من الكاتالاز على أربعة سلاسل متعددة البيبتيد ، يحتوي كل منها على أكثر من 500 من الأحماض الأمينية. يوجد في Catalase أيضًا أربع مجموعات من الهيم ، مصنوعة من حلقات البروتوبرفيرين ، تحتوي على ذرة حديدية واحدة. تقع هذه الحلقات داخل السلاسل الأربع.
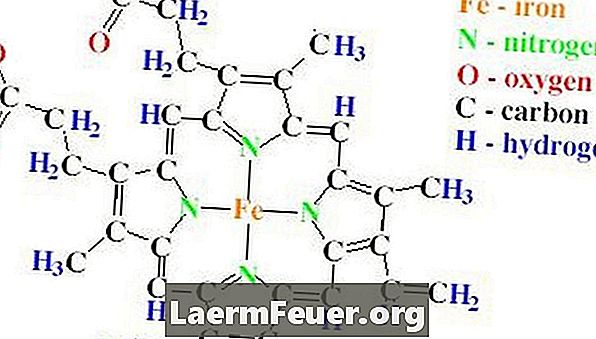
أهمية الكاتلاز
بيروكسيد الهيدروجين هو نتيجة ثانوية للعديد من الوظائف البيولوجية للكائنات الحية. تستخدم جميع الكائنات الهوائية الأكسجين في التنفس. غالبًا ما يكون نقص الأكسجين في الماء غير مكتمل ، ويمكن نقل إلكترون إضافي من أيون معدني ، مما يتسبب في تكوين بيروكسيد. ومع ذلك ، يتم إنشاء معظم بيروكسيد الهيدروجين أثناء إنتاج ATP في الميتوكوندريا. على الرغم من أن بيروكسيد الهيدروجين سام للخلايا الحية ، فإن رد الفعل لكسره مرة أخرى إلى الماء والأكسجين يحدث بسرعة وفعالية. يُعرف Catalase بأنه أحد أكثر الإنزيمات كفاءة ، حيث يبلغ حجم مبيعاته حوالي 200000 حدث / ثانية / وحدة فرعية. وبدون زيادة الكاتلاز في معدل التفاعلات ، يظل بيروكسيد الهيدروجين يضر بالخلايا.
العوامل التي تؤثر على فعالية الكاتلاز
يتم تغيير Catalase ومعدل نشاطه بعدة عوامل ، بما في ذلك درجة الحرارة ، ودرجة الحموضة ، وتركيز الملح ، وكمية الركيزة ووجود مثبطات أو المنشطات. تعتبر درجة الحرارة عاملاً مهماً في جميع التفاعلات الكيميائية الحيوية ، حيث يمكن أن تتسبب درجة الحرارة العالية في تغيير الأنزيمات. عندما يتم تغيير طبيعة الانزيم ، فإنه يغير شكله ، مما يؤدي إلى ربط الطبقة السفلية بكفاءة أقل ، وبالتالي تقليل معدل التفاعل. من ناحية أخرى ، حتى يتم الوصول إلى أقصى درجة حرارة (والتي تختلف عن كل نوع من أنواع الكاتالاز) ، فإن معدل التفاعل سيزداد مع درجة الحرارة. يتم قياس درجة الحموضة ، وهي مقياس الحموضة أو تركيز أيونات الهيدروجين في محلول ، على مقياس من 0 إلى 14. وبما أن المحلول يصبح أكثر حمضية (أقل من 7) ، يمكن للإنزيم الحصول على أيون هيدروجين من المحلول وبما أن المحلول يصبح أكثر أساسية (أعلى من 7) ، فقد يفقد أيون الهيدروجين. يمكن لأي من هذين التطرفين أن يقلل من معدل التفاعل ، لأن روابط الكاتالاز الكيميائية تتغير. هناك نوعان من مثبطات: مثبطات غير تنافسية ، والتي ترتبط بموقع ليس بالموقع النشط ، ومثبطات تنافسية ، ترتبط بموقع نشط من الكاتالاز. كبريتات النحاس هي مثبط غير تنافسي معروف من الكاتالاز ، ويعرف السيانيد كمثبط تنافسي. بشكل عام ، مع زيادة كمية بيروكسيد الهيدروجين ، سيزداد معدل التفاعل أيضًا. ومع ذلك ، تتبع التفاعلات الأنزيمية معادلة Michaelis-Menten ، التي تقول إن كل تفاعل سيصل إلى نقطة تشبع ، بمعنى أنه عند معدل التفاعل الأقصى ، لن يكون لإضافة مزيد من الركيزة تأثير.
استخدامات أخرى من الكاتلاز
بما أن الكاتلاز موجود في جميع الكائنات الحية تقريبًا ، فهو أحد أكثر الإنزيمات التي تمت دراستها. وقد أدى هذا إلى إيجاد وظائف أخرى لهذا الإنزيم الفعال. يستخدم Catalase لعلاج الجزء الداخلي من البلاستيك لحزم الطعام. يمنع الأكسدة ، وبالتالي يساعد على حفظ الطعام. يستخدم الكالتيز أيضًا أثناء عملية التعقيم الباردة وهي عملية للحفاظ على الحليب والجبن من خلال معالجة بيروكسيد الهيدروجين. يستخدم هذا الانزيم لإزالة أي آثار متبقية من بيروكسيد الهيدروجين.